最近ではES・iPS細胞から、脳、網膜、腸管、肝臓、膵臓、肺、腎臓など、様々なミニ臓器(のようなもの)が作られるようになってきました。この分野の技術の進歩は著しく、今回の論文では、ヒトの初期胚の神経管構造を培養皿上で作ることに成功しました。しかも再現性が高いという事ですので、神経系の組織を安定的に・選択的に分化させる技術として、今後、発生研究、再生医療などの分野でどのように使われていくか楽しみです。
“Human neural tube morphogenesis in vitro by geometric constraints”
Eyal Karzbrun et al., Nature. 2021 Oct 27. doi: 10.1038/s41586-021-04026-9. Online ahead of print.
https://www.nature.com/articles/s41586-021-04026-9
・ヒト初期発生において神経および非神経外胚葉が神経管の折り畳みの形態形成に必要かつ充分である。
・神経管の折り畳みを駆動するために、(1)神経外胚葉の頂端収縮、(2)非神経外胚葉による細胞外マトリックス合成を介した基底接着、のメカニズムがある。
・上記のメカニズムを薬理的に阻害すると、形態形成不全を引き起こす。
・神経組織の幅が神経管の形状を決定した。
<技術解説>
・オルガノイドについて
(旧)理研CDBの笹井芳樹先生のグループが、ES細胞からマトリゲルを使った3次元分化培養で網膜組織形成に成功してから(Eiraku et al., Nature 2011)、大脳、腸管、肝臓、膵臓、肺、腎臓など、様々な組織の3次元培養が行われるようになりました。これらは、それぞれの器官(Organ)を模擬していることから、Organoid、オルガノイドと呼ばれます。
・Organ-on-a-chip
少しずれますが、今回の論文で出てくるマイクロパターンコーティングは、Organ-on-a-chipを想起させます。これは、人体臓器を模したチップ上に微細な流路を形成させることで、肺、肝臓、小腸など様々な臓器の環境を模擬するチップが研究開発されています。これにより、動物実験とはパラレルで、実際のヒト組織に近いサンプルで創薬研究ができると期待されています。今回は初期胚の形成ですが、今後分化後期のオルガノイドを形成するためにはOrgan-on-a-chipなどの技術も必要になるかもしれません。
<論文の流れ>
・再現性のあるオルガノイドの形態形成
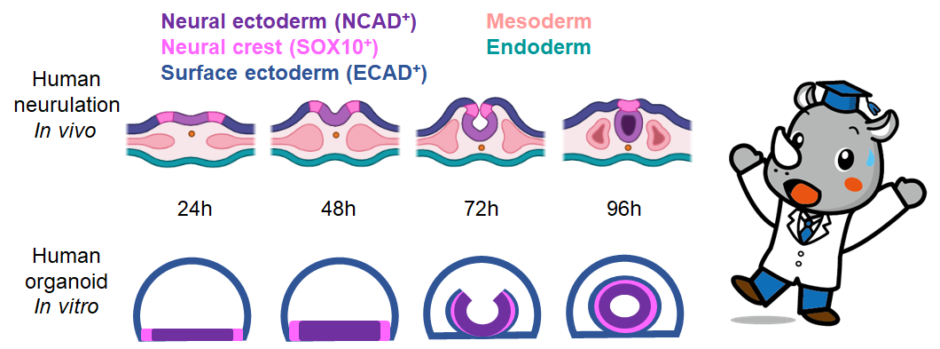
生体内の器官形成を模擬することによって、ヒト初期胚における神経管の形成を再現することに成功した。まず、初期状態では、表面コートのマイクロパターンによって、2次元の幹細胞の長方形シートを作る。次にマトリゲル(培地がゲル化する細胞外基質)を添加することによって、ドーム状の内腔(Lumen)をもつ3次元構造を作る(この状態では細胞はまだ未分化)。ここにモルフォゲン(器官形成を決定する因子)を添加すると、器官分化が開始する。この論文の系ではTGF-β 阻害剤 (SB 431542), 続いてbone morphogenetic protein 4 (BMP4) を添加したところ、チューブ状の神経組織と、これを取り囲む表層外胚葉(Surface ectoderm)を作ることができた。これは初期胚の神経管の組織的ないくつかの特徴を模擬していた。このような形態形成は2次元の培養系のままでは見られなかった。
・神経胚形成の特徴の再現
In vitro(試験管内)のオルガノイドの形態形成は、In vivo(生体内)の神経胚形成の順番通りになっていて、神経板形成、肥厚化、屈曲、折り畳み、閉塞をたどる。BMPは、ドームの外側の細胞を表層外胚葉に分化させる一方で、ドームの内部の細胞は、神経胚に分化する。神経胚は盛り上がり、内腔を作りながら管状構造に変化する。管状構造は二層になっており、内側がN-cadherin (NCAD), PAX6, OTX2陽性の神経外胚葉組織、外側が、E-cadherin (ECAD), keratin-8 (KRT8) , TFAP2α陽性の非神経の表層外胚葉となっていた。神経と非神経外胚葉組織の間には、SOX10, PAX7, FOXD3, P75陽性の神経堤細胞(neural crest cells)が見られた。また、この境界面では、fibronectinとfocal adhesions(接着斑)が見られた。中胚葉のマーカーは見られなかったことから、神経管形成には中胚葉からの力学的な作用は必要ないとわかった。BMPシグナルがないと神経分化は起こらなかったことは、神経管の形成には神経と非神経外胚葉組織の両方が必要充分であることを示唆している。
・神経折り畳み中のSingle-cell analysis
Single-cell RNA sequencing (scRNA-seq)遺伝子発現解析を、BMP添加後 24, 48, 72, 120hの細胞でおこなったところ: neural ectoderm (NE), 2種類のsurface ectoderm cells (SE1 and SE2), neural crest (NC)に分離することができた。
NEは、前脳マーカー (PAX6, OTX2, EMX2, SIX3 and LHX2)、SE1は、non-neural ectodermマーカー (CDH1, GRHL3 and GATA3)、SE2は、epidermal differentiationマーカー (ANXA1, KRT8 and KRT18)を発現していた。NCは、neural plate border マーカー(PAX3 and PAX7), neural crest specificationマーカー (SOX10 and FOXD3), 遊走マーカー (SNAI1, SNAI2, TWIST1 and RXRG), 間葉への多様性マーカー (PRRX1, PRRX2 and FOXC1), 骨芽細胞マーカー (MEF2C and DLX2), ocular developmentマーカー (SOX4, PITX2 and FOXE3)を発現していた。神経と非神経外胚葉組織境界面でのFibonectin蓄積を考えると、表層外胚葉由来の細胞外基質が神経板がめくれて管状になる過程に必要であることが示唆される。
・神経管形成不全、Neural tube defect (NTD)のモデル
以下の3つの阻害剤を用いて、この実験系が神経管形成不全モデルとして適用できるかどうかについて検討した。
SHROOM3-RHO kinase (ROCK) signalling:ROCK阻害剤 (Y-27632)
fibronectin matrix:HSP-90阻害剤(novobiocin)
NTD-associated drug:バルプロ酸(valproic acid)
ROCK阻害剤添加により、神経組織の肥厚化がみられ、カーブが減少することで折曲がりが消失する。これは、Apical側(内腔側)の細胞骨格系の形成阻害により収縮ができないことに対応していると考えられる。
HSP-90阻害剤添加により、神経板が薄く、平板になった。これは、神経誘導が停止している表現型と考えられる。
バルプロ酸添加により、神経組織領域が増大し、神経と非神経外胚葉組織境界面が減少していた。
・神経板のサイズセットと神経管の形状について
神経板の幅は、体軸に沿ってサイズが異なる。例えば、頭側は、500μmで、尾側は100–200μmとなっている。そこで、初期条件のマイクロパターンの長方形の幅を様々に変えることで、できる神経組織の形状を調べた。
すると、狭いマイクロパターンでは、中心で折れ曲がるU字型の神経管ができるのに対して、幅150μm以上のマイクロパターンでは、両脇に2点の折れ曲がりができる内腔構造が形成された。この神経管の形状は、実際のヒト胚神経管の形成と合致している。
・神経管の作製が培養皿上でできるのは驚き
>オルガノイド技術もここまできたかという感じ。この論文では、外胚葉の相互作用だけで、神経管が形成されるという事を証明している。逆に今後、内胚葉、中胚葉との相互作用がどう効いてくるかも調べられそう。
・神経管のLumen形成は、細胞外基質とApical収縮の2つの作用で説明できる
>神経管が、なぜ「管」の形状になるかということについて、数理モデルも使いながら、この二つの作用で説明できることを主張している。生命の仕組みという意味でとても興味深い。
・より再現性の高い神経組織の創出が可能になる?
>一般的にオルガノイドの培養は分化効率にばらつきが大きく、再現性が課題となっています。この方法で安定的に各種脳組織や、脊髄神経組織が分化ができるならば、今後の発生研究や再生医療などに方法論として大きく貢献しそうです。
人間の臓器形成を理解することは、広範囲にわたる医学的意味を持つ科学的課題です。三次元幹細胞培養は、ヒト細胞の分化への洞察を提供してきました。ただし、現在のアプローチでは、足場のない幹細胞凝集体を使用しています。これにより、再現性のない組織形状とさまざまな細胞運命パターンが発生します。これでは毎回、臓器形成を再現することは難しいという課題があります。ここでは、微細パターン化された幹細胞を正確な3次元の細胞運命パターンと臓器形状に自己組織化することを可能にするチップベースの培養システムを紹介します。このシステムを使用して、培養皿の中のヒト幹細胞から神経管の折り畳みを再現します。神経が誘導されると、神経外胚葉は折りたたまれて、非神経外胚葉で覆われた長さ1ミリメートルの神経管になります。折り畳みは90%の忠実度で発生し、解剖学的には発達中の人間の神経管に似ています。我々は、神経および非神経外胚葉が折り畳みの形態形成に必要かつ十分であることを発見しました。そして、フォールディングを駆動する2つのメカニズムを特定しました:(1)神経外胚葉の頂端収縮、(2)非神経外胚葉による細胞外マトリックス合成を介した基底接着。薬物を使用してこれらの2つのメカニズムを標的にすると、神経管欠損症と同様の形態学的不全を引き起こしました。最後に、神経組織の幅が神経管の形状を決定することを示します。これは、前後軸に沿った形態が、分子勾配に加えて神経外胚葉の形状に依存することを示唆しています。私たちのアプローチは、健康と病気における人間の臓器の形態形成の研究への新しいルートを提供します。
Eyal Karzbrun et al., Nature. 2021