お腹が空いていると、ついつい余計に食べ過ぎてしまいますね。
今回の論文では、マウスが空腹時によりショ糖を活発になめる仕組みを調べています。
神経伝達ペプチドのエンケファリンが関与しているそうです。
多分ヒトでも同じような仕組みになっているのでダイエットなんかにも応用できる?
“An endogenous opioid circuit determines state-dependent reward consumption”
Daniel C. Castro et al., Nature. 2021 Oct 13
https://www.nature.com/articles/s41586-021-04013-0
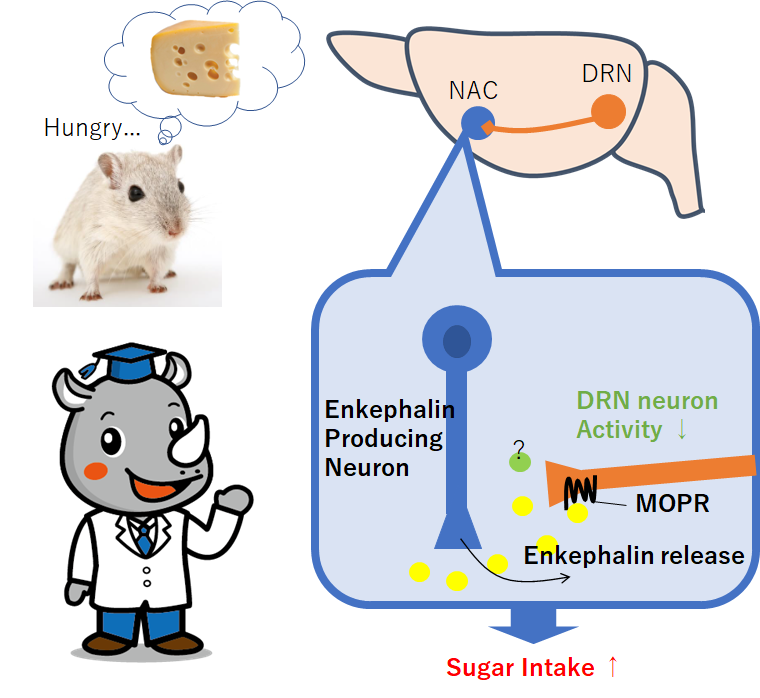
・マウスの報酬消費行動には、特定の背側縫線核(DRN)から側坐核(NAC)への投射時に作用するµ-オピオイドペプチド受容体(MOPR)の働きが必要とわかった。
・MOPRシグナルがNACの報酬時の神経活動を一時的に抑制することがわかった。
・MOPRのリガンドはDRN神経から放出されるエンケファリンとわかった。
この論文、上で見ると結論は比較的シンプルなのですが、
最新の研究手法を色々やっていて、すごい仕事量です。
出てきた神経科学の研究手法を解説していきます。
GCaMP6sカルシウムイメージングについて
神経活動を見るのによく使われるのがカルシウムイメージング技術です。
カルシウムは神経が活動すると細胞内でダイナミックに変化するので、(ミリ秒単位で)
イメージングでたくさんの細胞を同時に観察するのに都合が良いです。
このGCaMPシリーズは、クラゲの蛍光タンパク質GFPを改変したもので、
カルシウムが上がると光ります。
Optogenetics、光遺伝学について
チャネルロドプシンという光感受性のチャネルを特定の細胞に発現させることで、
光を当てたときに、神経活動を起こさせたり、逆に抑えたりすることができるので、
狙った神経回路を刺激したり抑制したりして動物の行動を制御できたりします。
これとは別に、薬物で行動を制御するDREADDという手法も使っています。
CRISPRゲノム編集について
2020年のノーベル賞なので聞いたことがあるかもしれません。
CRISPR-Cas9というゲノム編集技術は、ガイドRNAを使うことで、
様々な配列を認識して、その部分を編集(置換したり、切り取ったり)できます。
今回は、ウイルスで細胞に感染させエンケファリンに変異を入れ消失させています。
<論文の流れ>
・空腹時のµ-オピオイドペプチド受容体(MOPR)の役割
ネズミを通常時と、24時間エサを与えない(food deprivation, FD)で行動比較。
ショ糖(スクロース)のエサの消費量を調べると、(当然?)FD群で増えるが、
MOPRに選択的な拮抗阻害剤CTAP17を加えると、ショ糖の消費量が抑えられた。
また、MOPR(Oprm1)のノックアウト(KO)マウスでもショ糖消費量上昇が消失した。
上のKOマウスでは、マウス全体でMOPRがノックアウトされているので、
特定の細胞だけでノックアウトする(Conditional Knock-Out, cKO)マウスを使った。
まず、NACに投射していることが知られる、Preprodynorphin(Pdyn)陽性神経、
Preproenkephalin(Penk)陽性神経を、それぞれノックアウトすることができる、
Pdyn-Creと、Penk-Creマウスを使う(Oprm1-fl/flマウスと掛け合わせる)ことで、
それぞれの細胞でcKOを作ることができる。<ごめんなさい、ここの詳細割愛>
これにより、Penk陽性細胞のMOPRの発現が必要で、
また、NACに投射している神経のMOPRがショ糖消費量上昇に必要と分かった。
・背側縫線核(DRN)から投射するPenk陽性神経がMOPRを発現
NACから逆行性に神経をウイルスで標識することができその中で、DRNに注目。
DRNでは、Penk (28%), Oprm1 (31%), Tph2 (19%) が陽性で、
PenkとOprm1が共発現(60%)していて、NACに投射する。
この神経細胞の活動(GCaMP6s蛍光)を脳内の観察ファイバーで確認すると、
報酬活動にともなって、NACの活動が抑制されており、
オピオイド拮抗薬naloxone を加えると、この抑制がなくなった。
ということで、NACで報酬活動時にMOPRを介した神経活動抑制が観察された。
・DRN>NAC神経回路の操作
Oprm1-KOでは、ショ糖消費上昇が起こらないが、
Penk陽性細胞にだけ、MOPR(Oprm1)を発現させてやると、消費が回復した。
次に光遺伝学を使って、DRNの神経を操作してやる。
オピオイド拮抗薬naloxoneによる、ショ糖を舐める動作が通常は落ちるが、
DRNを活性化させてやると、これが落ちなくなった。
・MOPRリガンドの同定
NACにおいて、DRNからの投射があり、MOPRを介して神経活動を抑制する、
という流れが見えてきているが、NACにおける、MOPRリガンドは何か?
という疑問だが、NACにおいては、(投射細胞も持っている)エンケファリンが、
高密度に存在していると分かっている。
そこで、まずはNACに存在するPenk陽性神経の活動をGCaMP6sで調べた。
すると、ショ糖の舐める動作時に反応する様々なタイプの応答が見られた。
(クリアに解釈するのは難しかったように思えます。)
次に、Caspaseを使って、Penk陽性神経を特異的に細胞死を起こすと、
FDによるショ糖の消費量上昇が下がった。
次に、CRISPR-Cas9で、Penk陽性神経で、Penk遺伝子をノックアウトすると、
同様に、FDによるショ糖の消費量上昇が下がった。
さらに、このときにDRNで活動を観察すると、ショ糖を舐めるときの活動低下が、
ノックアウトしたマウスでは見られなかった。
designer receptor exclusively activated by designer drugs (DREADD)
で抑制性HM4D(Gi) または興奮性 HM3D(Gq) でテストすると、FDによって、
Gi-DREADDでショ糖消費が減少、Gq-DREADDでショ糖消費が増加した。
これらから、エンケファリンがおそらくMOPRのリガンドであると考えられる。
・DRN-NAC回路形成はどのように決まるのか?
>発生の段階で既に決まっているのか?それとも学習で獲得するものなのか?
子マウスの生存本能の時点から決まっていそうな気もする。
・naloxone CTAP17の違い?
>一番初めに、CTAP17がやってきて、その後はNaloxoneが使われている。
CTAP17の方が選択性が高い?Naloxoneでショ糖消費の実験はしていない。
・NACにおける抑制シグナルはどのように伝わるか?
>GABAが関係している?って読み返すとPenkとD2R(抑制性ドーパミン受容体)が
共局在しているというのがイントロにあり、ドーパミンが関係する?
・オピオイド受容体の機能が多様で調べるのが困難だった
>これまで、機能が複雑すぎて分からなかったのが、CRISPRとかを使うと、
色々できるよという論文と言うことになるのかも知れない。
µ-オピオイドペプチド受容体(MOPR)刺激は、呼吸、鎮痛、報酬行動を変化させ、薬物乱用や過剰摂取を引き起こす可能性があります。その明らかな重要性にもかかわらず、消費行動のMOPR調節の内因性メカニズムは不明のままです。ここでは、マウスの報酬消費の内因性MOPR調節が、特定の背側縫線核から側坐核投射時に作用することを報告します。縫線核末端のMOPRを介した阻害は、消費反応を決定するために必要かつ十分ですが、選択されたエンケファリン含有側坐核アンサンブルは、報酬消費の前に関与しており、局所エンケファリン放出が内因性MOPRリガンドの源であることを示唆しています。側坐核エンケファリンニューロンの選択的調節およびCRISPR-Cas9を介したエンケファリンの破壊は、この発見を裏付けています。これらの結果は、状態に依存する消費行動の基本的な内因性オピオイド回路を分離し、報酬のオピオイド調節の新しいメカニズムを示唆しています。
Daniel C. Castro et al., Nature. 2021