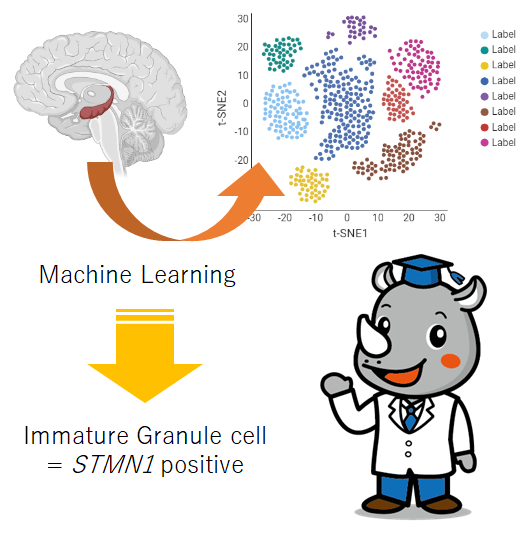
海馬の神経細胞は成人になっても分裂し続けるらしい、という話がでて久しいですが、それが本当なのかどうか、議論が続いていました。この論文では、確かに成人でも未分化な神経細胞がいるということ、それがどのような性質があるかなどを詳細に調べています。
https://ceitaro.com/human-imGC/
“Molecular landscapes of human hippocampal immature neurons across lifespan”
Yi Zhou et al., Nature. 06 July 2022
https://doi.org/10.1038/s41586-022-04912-w
・ヒト海馬における生涯を通じて異なるステージのimGCを同定した
・ヒトimGCsの年齢依存的な転写ダイナミクスを観察した
・アルツハイマー病では、imGCsが減少、遺伝子発現も変化している
・成体ヒト海馬における神経前駆細胞の存在、神経新生能を示した
<技術/知識解説>
・単核RNAシークエンス(Single nuclei RNA sequencing)
以前の投稿参照。
https://ceitaro.com/human-ex-inh-neuroprogenitor/
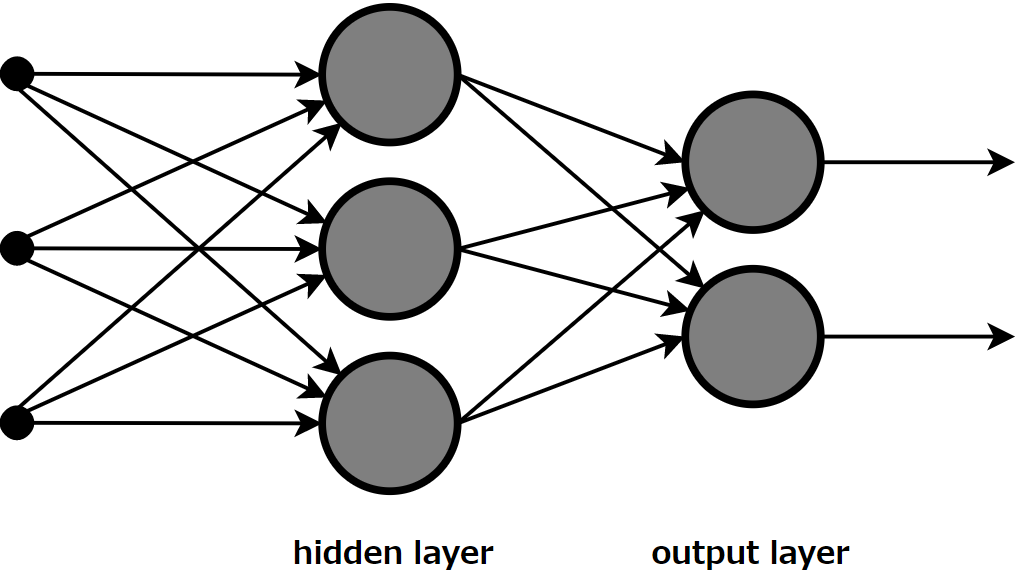
・機械学習(Machine Learning)
理論自体は古くからあるもので、下図のように入力層と出力層の間に中間層があるニューラルネットワークを介して情報を伝達する。この時、中間層のシナプスを重みづけすることで、学習が成立する。近年、処理速度の向上により、中間層をより複雑にすることで、より精密な学習が可能となってきている。
https://ja.wikipedia.org/wiki/%E6%A9%9F%E6%A2%B0%E5%AD%A6%E7%BF%92
<論文の流れ>
・ヒト海馬の単核RNAシークエンス解析
imGCsが豊富に存在する発達段階である乳児海馬4検体のsnRNA-seqデータから、教師なしクラスタリングにより、14のクラスタが同定された。imGCsは、未熟な神経細胞マーカーであるDCXと、汎GCマーカーであるprospero homeobox 1 (PROX1)を発現していた。一方、カルビンディン(CALB1)は一部のimGCsで発現しているが、成熟GC(mGCs)においてより濃縮されている。DCX+ imGCsは他の細胞と混在しており、より細かいパーティションで分離することはできなかった。そのため、従来の教師なし法では、ヒトsnRNA-seqデータにおけるimGC集団の同定には不十分であった。
・機械学習によるimGCの同定法
まず、マウス海馬の年齢層別のscRNA-seqデータセットを用いて未熟な神経細胞を同定した。ヒトの解析と同様に、P5マウス海馬のGCクラスターから高信頼度のDcx+Prox1+Calb1-imGCをプロトタイプとして選択した。同様に、非神経細胞プロトタイプ(アストログリア、オリゴデンドロサイト前駆細胞(OPC)、ミクログリア)についても選択し、トレーニングに使用した。ヒト乳児imGCプロトタイプ細胞(GCクラスタのDCX+PROX1+CALB1-細胞)と、すべての主要な非神経細胞タイプのプロトタイプ(アストロサイト(Astro)、OPC、成熟オリゴデンドロサイト(mOli)、ミクログリア)を99%の精度で同定できた。ヒトimGCsは、神経系の発達、神経発生、シナプス形成に関連する遺伝子オントロジー(GO)用語に富み、遺伝子ネットワークにおいて遺伝子ネットワークではDCXと密接に関連していた。
私たちがモデル分類したヒトの細胞種と、成体マウスデータセットで公表されているクラスタアノテーションと独立した分類器を用いて、対応する細胞種を比較した結果、トランスクリプトームが良く一致することを発見した。このように一般性が保存されているにもかかわらず、ヒトとマウスのimGCについて、機械学習モデルによって個別に生成された正相遺伝子の重みは、実質的な種差を示した。この中で我々は、抗体の利用可能性に基づいて候補をスクリーニングし、チューブリン脱重合タンパク質であるSTMN1に注目した。DCX+PROX1+ imGCsの93.8%はSTMN1+であった。一方、STMN1+PROX1+細胞の91.4%はDCX+、20.7%はCALB1+であった。
・ヒトimGCは、生涯豊富に存在する
我々はまず、出生前のヒトの海馬と前頭前野の公開データを調べたところ、多くの細胞での類似性スコアが高い細胞(P ≥ 0.85)を発見した。海馬ではGC、一部のCAニューロン、GABA作動性ニューロン、大脳皮質の一部のニューロンなどであった。
次に、ヒト出生後海馬標本のsnRNA-seqを年齢別に実施した。
小児、思春期、成人、老化の各ステージで、それぞれ4〜5人の被験者を用意した。ヒトimGCプロトタイプと高い類似性(P≥0.85)を持つ細胞は、すべての海馬で同定された。そのほとんどがUMAPプロットで一緒にクラスタリングされており、両者の転写産物が近接していることが示唆された。我々は3つの成体ヒト海馬のデータセットで未熟なニューロンを同定した。成体ヒトの成体嗅上皮は継続的なニューロン新生を示し、未熟なニューロンを同定した。一方、成人ヒトの前頭葉皮質、小脳、視覚皮質、中側頭回、前頭前野のデータセットからは、未熟なニューロンはほとんど同定されなかった。各年齢層におけるGCクラスター内の全細胞に占めるimGCsの平均割合は、出生前の段階で51.8%、乳児期で9.4%、4歳以降で3.1~7.5%であった。DCX+PROX1+imGCsの70%以上がSTMN1+であったのに対し、STMN1+PROX1+imGCsで、わずか18-39%のみがCALB1+であった。
・生涯にわたるヒトimGCの分子プロファイル
年齢を問わず、ヒトimGCsに共通する分子的な特徴を同定するために、我々はimGCsとそのmGCを異なる年齢で比較した。その結果、すべての年齢のimGCsにおいて、神経系の発達に関連する遺伝子(NEUROD1、BHLHE22など)、イオン輸送(FXYD7、KCNQ5)、神経突起の発達(SEMA6DやNR2F1)に関連する遺伝子が、濃縮されていることがわかった。これらの遺伝子のうち、年齢に関わらずマウスimGCsに濃縮された相同遺伝子(例えばFXYD7)と重複するのは15.5%に過ぎず、このデータは実質的な種間の違いを示している。さらに我々は、標本年齢と相関する顕著な時間的トランスクリプトームシフトを観察した。この相関は、標本年齢(ピアソンのr = 0.813)と相関していた。この相関は、mGCではなくimGCに特有のもので、調査した期間中、ヒトでは観察されたが、マウスでは観察されなかった 。
遺伝子共変動カイネティクス解析では、5つの異なる年齢依存性パターンが検出された。これらは、グルタミン酸受容体シグナル伝達経路の連続的なアップレギュレーションと、神経細胞の移動と投射を司る神経細胞の移動と突起の形態形成に関連する遺伝子を含む。
様々な脳疾患へのimGCsの脳疾患への関連を探るため、アルツハイマー病、自閉症スペクトラム障害、てんかん、大うつ病性障害、統合失調症について疾患リスク遺伝子の濃縮解析を行ったところ、特定の年齢で選択的に発現していることを明らかにした。その多くは、アルツハイマー病の加齢期や自閉症スペクトラムの発達初期など、各疾患の病因とされる重要な時期と一致していた。
・アルツハイマー病におけるimGCの制御異常
神経疾患がimGCsにどのような影響を及ぼすかを直接的に調べるために、我々はアルツハイマー病患者8名とその対照者8名の海馬標本のsnRNA-seqを実施した。これらすべての標本において、imGCsはほぼGCクラスターにのみ存在し、対照群に比べ、アルツハイマー病では全GCに占めるimGCsの割合が2倍低く、一方、サンプルごとに配列決定された全細胞に占めるGCの割合はほぼ同じだった。
定量的解析により、アルツハイマー病のimGCsで発現低下している遺伝子は14種類あり、その多くはシナプス可塑性やシグナル伝達(例えば、NRXN1)に関連する遺伝子であった。imGCを中心とした細胞間相互作用解析により、imGCとアストロサイト、OPC、GABA作動性介在ニューロンおよびCajal-Retzius細胞との相互作用がアルツハイマー病において著しく減少していることが明らかになった。これは、ニッチ相互作用の異常を示唆する。
・出生後のヒト海馬のニューロン新生について
海馬の神経新生の能力を調べるため、ヒト海馬でGC運命特異的なKI67+PROX1+増殖性神経前駆細胞とTBR2+PROX1+IPCを観察した。しかし、成人ヒト海馬では、これらの前駆細胞の数は非常に少なく、imGCsのde novo生成の頻度が低いことが示された。一方、EdU+PROX1+の新生GCを観察したところ、新生GCが、2歳から61歳までの患者の10検体中8検体において、1-2週間培養後に観察された。これらの細胞は、S100B-とCALB1-であった。EdU+PROX1+細胞の80%以上がDCX+またはSTMN1+であり、また、EdU+TBR2+PROX1+のIPCも観察された。
・シングルセル(核)解析によって、これまでに調べられてきたマーカーに頼る方法でなく、機械学習による全体の解析によって逆にマーカーを決めることができるようになった。
>この手法はヒト海馬だけでなく様々な臓器で応用可能。
・掘り出したヒトimCGマーカーとして、STMN1を提唱。
>今後有用なマーカーとして使われるかも?
・アルツハイマー病でのimGCと他の神経とのインタラクションが重要
>メカニズムを調べて治療に応用できる可能性。
・ヒト海馬における分裂能のある未分化ニューロンの存在を示した
>一応、論争に決着がついた形だろうか。
成体海馬の神経発生から生じる未分化歯状顆粒細胞(imGC)は、げっ歯類では可塑性やユニークな脳機能に寄与し、ヒトの複数の神経疾患では制御異常が見られる。成体海馬imGCsの分子的特徴についてはほとんど知られておらず、その存在さえも議論されている。我々は、機械学習を用いた解析手法により単核RNAシークエンスを行い、ヒト海馬における生涯を通じて異なるステージのimGCを同定し、その存在を定量化した。また、ヒトimGCsの年齢依存的な転写ダイナミクスを観察し、マウスとは異なる細胞機能、ニッチ相互作用、疾患との関連性の変化を示した。また、アルツハイマー病では、imGCsが減少しており、その遺伝子発現も変化していることを見いだした。最後に、成体ヒト海馬における少数の歯状顆粒細胞運命特異的に増殖する神経前駆細胞の存在と、培養外科標本を用いて、これらの神経新生の能力を証明した。これらの知見から、成人の海馬には、低頻度の神経新生と長期の成熟を経ても、相当数のimGCが存在することが示唆され、その生涯を通じた分子特性と、アルツハイマー病における特徴が明らかにされた。
Yi Zhou et al., Nature. 2022.