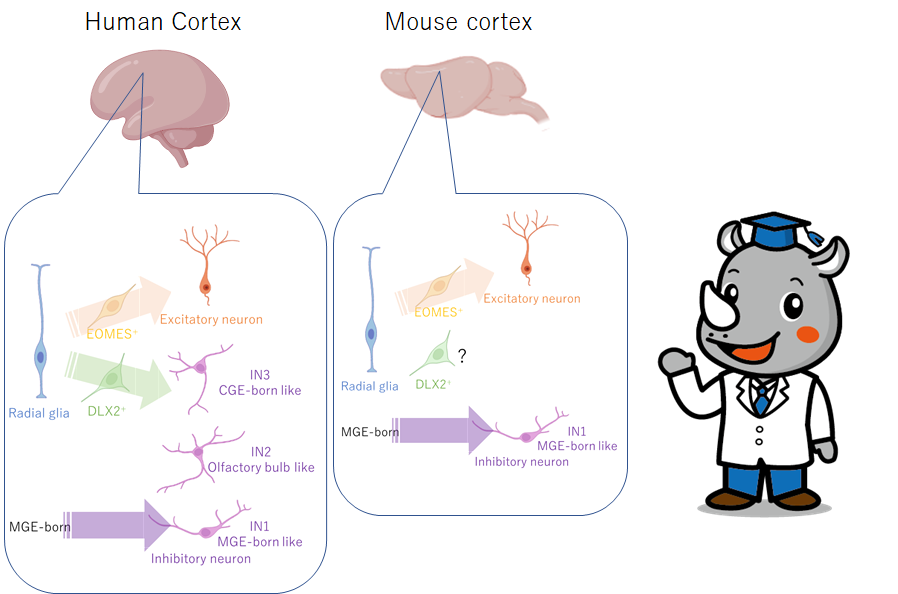
ヒト脳の特徴が最近立て続けに明らかになってきています。この論文では、マウスで言われていた「神経前駆細胞は興奮性と抑制性が早い段階で決まっている」という定説が、ヒトでは異なることを示しました。
“Individual human cortical progenitors can produce excitatory and inhibitory neurons”
Ryan N. Delgado et al., Nature. 2021 Dec 15. Published online
https://doi.org/10.1038/s41586-021-04230-7
・single-cell-RNA-sequencing-compatible tracer for identifying clonal relationships」(STICR)という細胞バーコードツールを開発した。
・STICRにより、初代ヒト皮質前駆細胞のクローン系統追跡し、興奮性ニューロンと大脳皮質介在ニューロンの両方を生成できることを示した。
・皮質で生まれたGABAニューロンの亜集団は、尾神経節隆起から生まれた皮質介在ニューロンに転写的に類似していた。
<技術/知識解説>
・ウイルスベクターについて
これまでも、ウイルスを使った遺伝子発現を使った研究をいくつか紹介してきましたが、少し特徴をまとめてみようと思います。ウイルスを遺伝子発現の運び屋(ベクター)として、利用して、実験ツールや治療方法開発が進んでいます。アデノウイルス(高発現、毒性強)、アデノ随伴ウイルス(毒性弱、導入遺伝子長が短い)、レンチウイルス(ニューロングリアに安定発現)、レトロウイルス(分裂細胞に選択的に感染発現)、センダイウイルス(ホストゲノムへの組み込み無)など色々特徴がありますが、この研究では、ニューロン、グリアに感染しやすい、レンチウイルスを用いています。
脳科学辞典(ウイルスベクターについて詳しく)
https://bsd.neuroinf.jp/wiki/%E3%82%A6%E3%82%A4%E3%83%AB%E3%82%B9%E3%83%99%E3%82%AF%E3%82%BF%E3%83%BC
・次世代シークエンス(Next generation sequencing, NGS)について
もはや、言葉が使い古されすぎていて、次世代って何だろう?という感じですが、今は昔、「ヒトゲノム計画」時代、後期に開発された、一度に大量のシークエンスを行うことができるシステムです。ざっくり、DNAを断片化してPCRで増幅し、蛍光色素で増幅している最中にイメージングしてシークエンスを画像で読み取るシステムです。DNA断片化するため、繰り返し配列など長いDNAの読み取りに難があるので、ロングリードのためのシークエンサーも開発されています。
https://www.jsap.or.jp/columns-covid19/covid19_2-4-1
「次世代」というのは、古典的なサンガーシークエンス(今でもちょっとしたシークエンスには使われています)に対比した表現です。(下でよくまとめられていたのでリンクします)
https://lifescience-study.com/1-nucleotide-sequence-analysis-by-dideoxy-method/
・DNAバーコードについて
DNA(RNA)をバーコードのように見立てて、解析する研究があります。これまでに、レンチウイルスを使って、細胞の系譜を調べるアイディアはあったと思いますが(下のリンクなど)、この論文ではこれをシングルセルレベルで解析が可能にしたという技術的な進歩があります。
https://www.cosmobio.co.jp/product/detail/clonetracker-lentiviral-barcode-library-50m-clt.asp?entry_id=34325
<論文の流れ>
・細胞系譜トレーサーSTICRのデザインと評価
このアプローチでは、レンチウイルスベクターに、EGFPレポーター遺伝子の3′-UTR (3′-untranslated region, 3′ 非翻訳領域は遺伝子下流で翻訳されない領域)に仕込まれたバーコード領域をシングルセルレベルで解析することができた。技術的には、最大125Mシークエンスを解析することができる。
barcode ‘collision’の確率—偶然に同じバーコードのなる確率が0.5%以下になる、250,000細胞より以下で解析をした。
・ヒト神経前駆細胞の細胞系譜トレーシング
ヒト胎生サンプル(gestational weeks 15 and 18, GW15 and GW18)のcortical germinal zone、または、germinal zones of the prefrontal cortex (PFC), primary visual cortex (V1) and medial ganglionic eminence (MGE)から細胞を採取した。シングルセル遺伝子発現解析(single-cell-RNA-sequencing)で調べたところ、121,290細胞は、3つの主要な細胞群に分けることができた— excitatory neurons, GABAergic inhibitory neurons and glia
inhibitoryとexcitatory neuronの中間的な細胞として、intermediate progenitor cells (IPCs) が見られた。これらを、DLX2+ IPCs (inhibitory trajectory) and EOMES+IPCs (excitatory trajectory)と名付けた。
トータルで、1,461 unique clonal barcodes, 1,324の多細胞 clonesを同定した。
GW15 samples and the GW18 V1 sampleでは、3種類にまたがるクローンが多く見られたが、GW18 PFC clonesでは、GABAergic inhibitory neuronsが他の細胞より多かった。
・ヒト皮質ニューロンとの関係性
ほとんど(66%; 829 of 1,252)の多細胞クローンが、少なくとも1つのexcitatory neuronを含んでいた。1.5% (19 of 1,252) のクローンがexcitatory neuronsのみで、51% (635 of 1,252) excitatory neurons, inhibitory neurons and gliaのコンビネーションだった。
・皮質で生まれたinhibitory neuronの解析
DLX2 に加えて、inhibitory-trajectory cells は一般的な抑制ニューロンマーカーの GAD1, ARX, SLC32A1 and DLX6AS-1を発現していた。これをさらに、発現遺伝子から3つのサブグループに分け、IN.1, IN.2 and IN.3 と名付けた。
IN.1 cells はSST+ cortical interneurons, including SST, NPY,TAC3 and NXPH1を発現していた。SST+ cortical interneurons は、MGEから主要に産生されることから、73% (492 of 671 cells) of IN.1 cells はMGE progenitorsに類似していると考えられた。cortical progenitorsから産生された、IN.1 cells は、0.3% (179 of 56,244 cells) のみであった。MGE-derived IN.1 cells は、canonical MGE-born interneuron genes, LHX6, NKX2-1, ACKR3 (CXCR7), PDE1A and MAFを発現していた。一方で、cortically born IN.1 cellsは、これらを発現していなかった。
IN.2 and IN.3 trajectory cells は、caudal ganglionic eminence (CGE) マーカー遺伝子 SCGN, SP8, PCDH9 and BTG1を発現していた。IN.2 and IN.3 cellsは、cortical progenitors由来で、MGE progenitorsとは関連が見えないという点で、 IN.1 cellsとは異なっていた。IN.2 markersの、TSHZ1, PBX3, MEIS2, CALB2, CDCA7L, SYNPR and ETV1は、mouse olfactory bulb interneuronsのマーカーであり、IN.3 marker genes のNR2F1, NFIX, PROX1 and NR2F2は、CGEに良く発現している。また、SOX6 and CXCR4は、cortical interneuronsで良く発現している。
すなわち、IN.2 cells は、olfactory bulb interneuronsに類似しており、IN.3 cellsは、CGE-born cortical interneuronsに類似している。
・異種移植モデルでの興奮性-抑制性クローン
GW15サンプルのSTICR-labelled cortical germinal zone cellsを、生後初期の免疫不全マウスの皮質に移植し、その後6週のサンプルを解析した。Excitatory neuronsが多くを占めており、 75.7 ± 8.4% 。次が、glia at 16.8 ± 6.3%。そして、interneurons 7.9 ± 3.2%であった。
クラスタリング解析の結果、85% (211 of 249) of GABAergic xenograft cluster-1 cells は、IN.3 trajectoryは、cortical interneuronsと類似していた。Few (4%; 9 of 249 cells) GABAergic xenograft cluster-1 cellsは、 IN.2 trajectoryであった。Xenograft-derived GABAergic IN.3neurons は、56 multicellular clones, 43 (77%) で、excitatory neuronsを含んでいた。細胞の形状を見ると、STICR-labelled cells は、皮質の層全体、嗅球にわたって、精巧な神経プロセスを伸ばしていた。8.3% (89 of 1,071)は、GABAを発現し、皮質の全体に分散していた。
・疾患との関連は?
>確か、精神疾患で、分化が早い時期のマーカーが関連していた気がする。このあたりが、ヒトにおける抑制ニューロンの分布に変化を与えている可能性はないだろうか。
・マウスでは、やっぱりない。じゃあ進化のどこから?
>このSTICR技術を使って、しっかりマウスでも実験してて(やっぱりNature)、マウスでは、これが起こらないことを示している。サルでもあるかもという話をしているが、実際どうなのだろう。皮質の拡大との関連性。皮質が拡大していく中でinhibitory/excitatory balance(E/Iバランス)を保つために、抑制ニューロンを余計に作り出す必要があるのかもというディスカッションあり。これはなるほど。
・ヒト脳オルガノイドで再現できるか?
>ヒト脳オルガノイドで見られてもおかしくなかったけど、この技術で初めて分かったとのこと。見えそうで見えていなかったという感じですね。抑制ニューロンの分化は比較的後期だそうで、そこも見えにくかった原因かも。
・神経分化変化のメカニズム?
>じゃあ、ヒトではどのような仕組みで前駆細胞が、興奮性、抑制性ニューロンの両方を作り出すようになったのか。マウスではShhシグナルが抑制ニューロンへのスイッチになる話があるそうで、それがどのように関わっているか。今後の課題だそうです。
大脳皮質は、多様な神経細胞やグリア細胞から構成される複雑な構造をしている。。大脳皮質は、神経伝達物質のグルタミン酸を利用する興奮性ニューロンと、γ-アミノ酪酸(GABA)を利用する抑制性介在ニューロンに大別される。これまでのネズミの発生研究により、興奮性ニューロンは大脳皮質に存在する前駆細胞から生まれ、皮質介在ニューロンは発達中の大脳皮質外の神経節辺縁に存在する別の前駆細胞集団から生まれるというモデルが有力である。しかし、ヒトの大脳皮質前駆細胞の発達の可能性については、これまで十分に検討されてこなかった。本論文では、ヒト大脳皮質前駆細胞が、興奮性ニューロンやグリアに加え、大脳皮質介在ニューロンの転写的特徴や形態を持つGABAニューロンも産生できることを明らかにする。私たちは、「single-cell-RNA-sequencing-compatible tracer for identifying clonal relationships」(STICR)という細胞バーコードツールを開発し、6つの標本から得られた1,912個の初代ヒト皮質前駆細胞のクローン系統追跡と、その子孫の転写の同一性とクローン関係の両方を把握することができた。皮質で生まれたGABAニューロンの亜集団は、尾神経節隆起から生まれた皮質介在ニューロンに転写的に類似しており、これらの細胞は興奮性ニューロンやグリアと頻繁に関連していた。この結果は、個々のヒト大脳皮質前駆細胞が興奮性ニューロンと大脳皮質介在ニューロンの両方を生成できることを示しており、ヒト大脳皮質における神経細胞の多様性の起源を理解するための新しい枠組みを提供するものである。
Ryan N. Delgado et al., Nature. 2021