今回は、ヒトの脳の発生に関する論文を紹介します。
チャールズ・ダーウィンの説を受け入れれば、
我々ヒトは、進化の過程でマウスのような小型の哺乳類から、
原始のサルのような動物を経て、脳を複雑に発達させてきました。
この論文では、レチノイン酸が、脳の発達に関連するという、
報告をしています。
“Regulation of prefrontal patterning and connectivity by retinoic acid”
Mikihito Shibata et al., Nature. 2021 Oct 1.
doi: 10.1038/s41586-021-03953-x. Online ahead of print.
https://www.nature.com/articles/s41586-021-03953-x
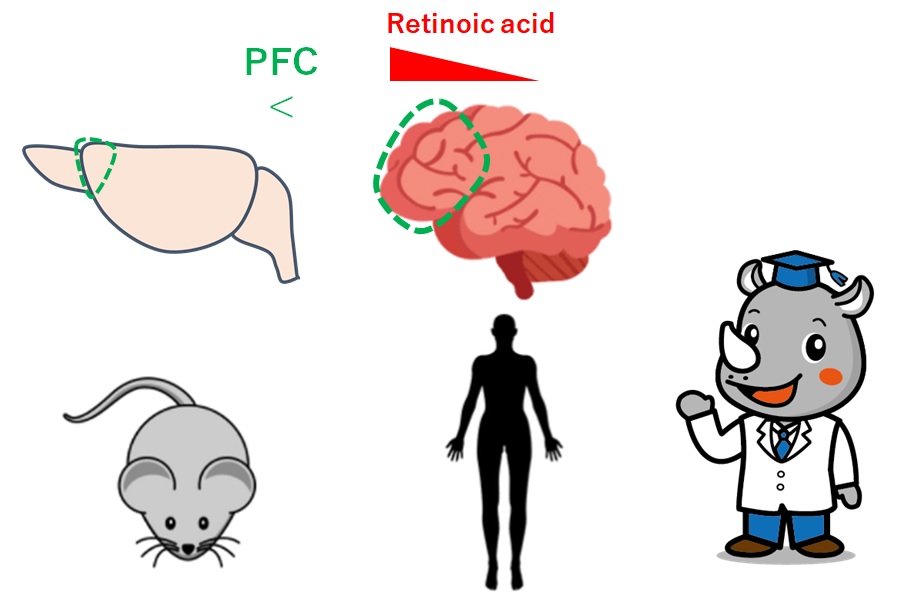
・発生段階でレチノイン酸は前頭前野から後部に濃度勾配がある。
・ヒト、サルの発生初期脳新皮質でレチノイン酸関連遺伝子発現勾配がある。
・レチノイン酸分解酵素が前頭前野のレチノイン酸シグナルを限局している。
・マウスモデルでは、レチノイン酸シグナルが、前頭前野の視床との接続、樹状突起形成、ヒトの脳第4層で特徴的な、RORBの発現を制御している。
先日、BRAINイニシアチブ細胞センサスネットワーク
(BRAIN Initiative Cell Census Network;BICCN)
というプロジェクトの発表が報告されてNatureに特集されてますが、
https://www.natureasia.com/ja-jp/nature/highlights/109653 (日本語サイト)
https://www.nature.com/articles/d41586-021-02493-8
脳の様々な領域がどのような分子機構で、発達しているか、
網羅的な解析から明らかになりつつあります。
(いずれ紹介するかも)
Brain Initiativeは、アメリカの脳の構造、機能、情報処理を解明する
国家的な研究開発計画で、2013年オバマ政権の時にスタートして、
計画の第一段階が終わったところのようです。
様々なツールの開発と、脳機能ネットワークの解明のために、
大きな予算がついて、活発に脳の研究がおこなわれています。
今はまだ、脳の全容が完全に分かったという状況ではないですが、
いずれこの分野で大きなブレイクスルーが起こるかもしれませんね。
今回この論文を読んでいて、
下のような論文(複数)を思い出しました。
Alex A. Pollen et al., Cell. 2015 Sep 24;163(1):55-67. doi: 10.1016/j.cell.2015.09.004. “Molecular identity of human outer radial glia during cortical development”
https://www.cell.com/fulltext/S0092-8674(15)01124-1
この手の論文では、ヒトの脳に特徴的な遺伝子発現を調べているもので、
ヒトの脳では神経幹細胞である放射状グリアが分裂し続けることが、
新皮質の拡大に重要であることを示しています。
現在では、シングルセルRNAシークエンス、エピジェネティクス解析、連続切片SEM、
など、様々な手法を駆使してこれらの問題にトライできる時代になっています。
さて、今回の論文の「レチノイン酸、RA」ですが、
実はとても古典的なシグナル分子です。
(それだけにそこに戻ったか感がある)
ビタミンAの代謝物質で、初期胚の発生に重要なシグナルと分かっています。
この濃度勾配は産生と分解のバランスで制御されていて、
このバランスが崩れると様々な奇形が生じます。
この下流の遺伝子も様々知られているのですが、
各臓器において状況が違いバリエーションがあるようです。
今回の論文ではCbln2に特に注目していて、
連報のもう一方の方で深掘りしています。(今回は割愛)
Mikihito Shibata et al., Nature. 2021 Oct 1. doi: 10.1038/s41586-021-03952-y. Online ahead of print. “Hominini-specific regulation of CBLN2 increases prefrontal spinogenesis”
https://www.nature.com/articles/s41586-021-03952-y
<論文の流れ>
・前頭前野(PFC)でRA関連遺伝子発現が上昇している
早期胚の前頭前野予定領域と運動野予定領域のいくつかを調べると、
遺伝子発現データで脳領域を分別することができた。
これらのリストを調べると、レチノイン酸関連遺伝子が見つかった。
CBLN2, RXRG, CDH8, MEIS2, RBP1などが上昇。
・前頭前野(PFC)でRAの勾配がある
ヒト、マカクザル、マウスの中期胚新皮質のRA濃度をELISAで測定すると、
前後軸でRAの勾配があり、前頭前野で最も高い濃度を示した。
・RA合成が霊長類では拡大している
RA合成酵素(ALDH1A1–ALDH1A3)、
RA分解酵素 (CYP26A1, CYP26B1 and CYP26C1)
の発現場所を調べたところ、ヒト、サルのPFCで上がっている。
マウスでは限局している。
・RAシグナルは、RARBとRXRGが仲介している
RAの下流シグナルとして、RARBとRXRG(両方、RA受容体)
の関与を調べるため、RARBとRXRGのダブルノックアウト(dKO)マウス
(両方の遺伝子が欠損したマウスライン)を解析したところ、
(ここでモデル動物であるマウスの有用性を使っています)
dKOマウスではRAのシグナルが落ちていて、
結果的にRAに関連した遺伝子群にが変化しているが、
特にPFCで変化が大きいと言うことが分かった。
・RARBとRXRGは前頭前野の接続を制御している
dKOの他の脳領域では、1次運動野、2次運動野、眼窩前頭皮質
とも比較したところ、やはりPFCが最も変化が大きい。
一方で、シナプス形成関連遺伝子のDLG4(PSD95)の発現が、
PFCと同様に、2次運動野でも落ちているのを確認した。
免疫染色でもDLG4陽性のシナプス形成の数が低下していた。
また、ヒト初代培養皮質神経細胞を使って、
RA添加によってDLG4が発現上昇、DLG陽性シナプス増加すること、
RA受容体阻害剤AGN193109で逆の作用があることを示した。
これには、CBLN2が関係していることを示した(もう一報の論文)。
MRIを使って構造的な接合を見ると、mediodorsal thalamus (MD)
(視床背内側核)との結合が弱くなっているのを確認した。
・異所性のRAはMD結合を拡張する
次は、RAシグナルを増加させる方向に操作します。
霊長類のPFCでは、Layer4が特徴的であると言われているので、
RAを増強したときの脳構造を確認するため、
RA分解酵素CYP26B1のノックアウト(KO)マウスを使いました。
このKOマウスは、周産期致死性で、胎生18日で調べたところ、
RAシグナルが1次2次運動野で上がっていて、
視床から、神経の投射が増加していること、
運動皮質でのLayer4マーカーのRorbの発現が上昇していること、
が分かった。
・RA合成の発生源は結局どこだ?
>RNAを見るIn situ hybridizationという手法でRA合成酵素を確認していて、
何となくヒトでは高くて、サルは中間、マウスで低い、画を見せているけど、
全体にうすらぼんやり。免疫染色で、アストロサイトだとか、
神経が放出してる?とも言ってるけど、いまいちハッキリしない印象。
・Rarb and Rxrg double-knockout (dKO) マウスについて
>生存できることに驚き。他の受容体がカバーするのかな?
・Cyp26b1KOマウスについて
>上と逆に、過剰だと死んでしまうんですね。
他の臓器で毒性が強いのでしょうかね。RAは取り扱いが難しいと言うことか。
そして、ヒトに近くなる?からといって、賢いマウスが生まれるわけではない。
CBLN2とDLG4の発現はどうなってる?
・RAシグナルの回路形成について
>Cyp26b1でわざわざ消してるということはRAがないことのメリットがある?
進化の過程、生存競争の中で、RAを使わないメリット。
回線が多岐にわたりすぎて運動機能が落ちるとか?
・脳オルガノイド研究について
>この仕事では、脳オルガノイドは使っていないけど、
iPS細胞から初期の脳構造が作れるようになっているので、
この知見を元にいろんなところが実験はもう進めているんだろうな~と想像する。
いろいろ物議のある論文を一応引用。
Elke Gabriel et al., Cell Stem Cell. 2021 Aug 12;S1934-5909(21)00295-2. “Human brain organoids assemble functionally integrated bilateral optic vesicles” doi: 10.1016/j.stem.2021.07.010. Online ahead of print.
前頭前野(PFC)とその中背側視床との接続は、認知の柔軟性と作業記憶にとって重要であり、自閉症や統合失調症などの障害で変化すると考えられています。大脳皮質の局所的パターン形成を支配する発生メカニズムはげっ歯類で特徴づけられていますが、PFC-中背視床接続の発達と霊長類の明確な顆粒層によるPFCの横方向の拡張の根底にあるメカニズムは不明です。ここでは、神経の発達と機能を調節するシグナル伝達分子であるレチノイン酸の前部(前頭)から後部(時間的)へのPFC濃縮勾配を報告し、胎児の発育の初期および中期のマカク、ヒトの新皮質におけるレチノイン酸によって調節される遺伝子を特定した。我々は、マウスと比較して、特に霊長類におけるレチノイン酸合成酵素の発現および皮質拡大を含む、レチノイン酸のいくつかの潜在的な供給源を観察した。さらに、レチノイン酸シグナル伝達は、CYP26B1、レチノイン酸分解酵素によって主にPFC予定部位に限局されており、これは将来の運動皮質でアップレギュレーションされます。マウスの遺伝子欠損モデルにより、レチノイン酸受容体RXRGおよびRARBを介したレチノイン酸シグナル伝達、ならびにCYP26B1依存性分解作用が、前頭前野および運動野の適切な分子パターン形成、PFC-中背視床接続性の発達、PFC内樹状突起形成、レイヤー4マーカーRORBの発現に関与していることが明らかになりました。これらの調査結果は、レチノイン酸シグナル伝達がPFCの発達において、そして潜在的にはその進化的拡大において重要な役割を果たしていることを示しています。
Mikihito Shibata et al., Nature. 2021