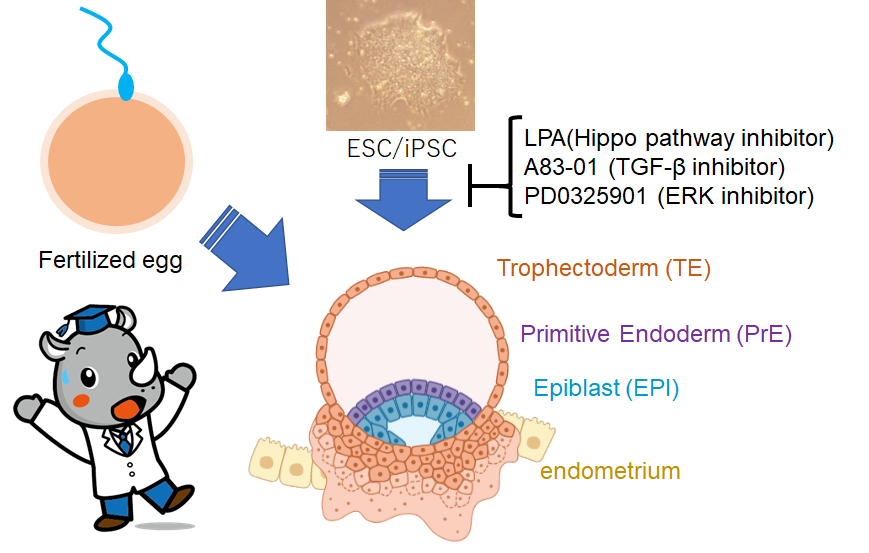
様々なオルガノイドが続々と出てきます。今回の論文では、受精直後の胚盤胞形成をES細胞、iPS細胞から行うことができるという技術を報告しています。ヒトの着床を培養皿の中で再現できるそうです。
“Human blastoids model blastocyst development and implantation”
Harunobu Kagawa et al., Nature. 2021 Dec 2. doi: 10.1038/s41586-021-04267-8. Online ahead of print.
https://www.nature.com/articles/s41586-021-04267-8
・ヒト多能性幹細胞から胚盤胞モデルを形成することができた(blastoid)。
・Blastoidは自然に第1軸を形成し、上胚葉が極性栄養外胚葉の成熟を誘導した。
・Blastoidはホルモン刺激を受けると子宮内膜細胞に付着する特異的な能力を獲得した。
<技術解説>
・Hippoシグナル
Hippoシグナル伝達は、細胞密度など細胞の周囲の環境を感知し、器官のサイズを調節します。Hippo経路では、Mst1/2キナーゼ群とSAV1が複合体を形成し、LATS1/2をリン酸化して活性化します。次いでLATS1/2キナーゼは、YAPとTAZの2つをリン酸化して、それらの活性を阻害します。逆に、細胞密度が薄いなどシグナルがないと、YAP/TAZが脱リン酸化され、核内に移行して様々な遺伝子の発現を誘導します。
https://www.cellsignal.jp/pathways/hippo-signaling-pathway
・ERKシグナル
Extracellular signal‑regulated kinase (ERK)は、Mitogen-activated protein kinase (MAPK)カスケードに含まれており、受容体型チロシンキナーゼ (RTK) やインテグリン、イオンチャネルなど、細胞の増殖や分化に関与する様々な種類の受容体によって活性化されます。活性化されたERK二量体は、細胞質基質の標的を制御するとともに核内に移行し、そこで遺伝子発現を制御する様々な転写因子をリン酸化します。
https://www.cellsignal.jp/pathways/mapk-erk-in-growth-and-differentiation
・TGFシグナル
Transforming growth factor-β (TGF-β) スーパーファミリーのシグナル伝達は細胞の増殖、分化、および幅広い生物システムの発生を制御する上で重要な役割を担っています。mDiaやROCKなどを介した細胞骨格の再構築に影響を与えるとともに、Smadファミリーのリン酸化、活性化を通して、様々な遺伝子発現制御を行います。その他、Erk、SAPK/JNK、p38 MAPK経路などのSmadに非依存的な経路にも影響を及ぼすことがあります。
https://www.cellsignal.jp/pathways/tgf-beta-signaling-pathway
<論文の流れ>
・3つのシグナル阻害 (Hippo/ERK/TGF)
胚盤胞(Blastocyst)は、卵割直後に形成される構造で、epiblast (EPI, embryonic), trophectoderm (TE, extraembryonic), primitive endoderm (PrE, extraembryonic)の3つの細胞系譜から成る。先行研究から、周辺の細胞は、Hippo pathway阻害で、TEに分化し、多能性幹細胞は、TGF-β and ERK pathwaysを阻害することで、TEび分化することが知られていた。そこで、Lysophosphatidic Acid (LPA, Hippo pathway inhibitor), A83-01 (TGF-β family receptors inhibitor) and PD0325901 (ERK inhibitor)を通常培地に添加することにより、複数のヒト多能性幹細胞(ES細胞、iPS細胞)から、安定してblastocyst様構造(blastoid)を効率的に得ることができた。
・胚盤胞(Blastocyst)ステージアナログ(似たもの)の形成
シングルセルRNAseq解析により、blastoidは、GATA2/GATA3 (TE), POU5F1/KLF17 (EPI), GATA4/SOX17 (PrE)の3種類の転写活性状態をもつことが分かった。これらは、実際のヒトBlastocystステージの細胞と相似しており、着床後ステージの細胞とは異なっていた。
この中には、Trophoblast analogs (TROP2+)が含まれており、多能性幹細胞から着床後に見られるTrophoblastへの分化遷移状態であると考えられた。Trophoblastは、TEの転写物 (ESRRB, GRHL1, OVOL1, GATA2, GATA3, TBX3, KRT19, CGA, CGB5, CGB7)を発現し、着床後マーカー(SIGLEC6, DPP4)は発現していなかった。
EPI analogs (TROP2-/PDGFRa-)は、ヒト多能性幹細胞に似ているが、blastocyst-stage EPI markers (KLF17, ATG2A, SUSD2, TFCP2L1, ZFP57, DPPA2, UTF1, PRDM14)を発現していた。
PrE analogs (PDGFRa+)は、多能性幹細胞からextraembryonic endoderm cell lines (nEND cells)への分化遷移状態であると考えられ、blastocyst-stage PrE markers(Early blastocyst: GATA6, MSX2, HNF4A. Late blastocyst: PDGFRA, GATA4, SOX17, HNF1B, FOXA2)を発現し、EPI genes (ARGFX, PRDM14, SOX2, NANOG, DPPA2, POU5F1)が低下していた。
・Hippo阻害が重要
周辺の細胞では、Hippo pathwayが阻害され、Apical domain(上部構造)が形成される。つまり、細胞塊に極性ができる。これは、Hippoシグナルの下流YAP1の核移行した細胞で、atypical Protein Kinase C (aPKC) and F-actin expression domains が形成されることに起因し、GATA2/3 expressionとも相関している。
LPA receptorリガンド (LPA and NAEPA)は、Hippo pathwayを阻害し、Blastocyst様構造形成を促進した。YAP1変異のYAP1(5SA)は常に活性化したYAP1で、細胞塊の空洞化を促進した。逆にVerteporfin(YAP1-TEAD interaction阻害)を用いると、Blastocyst様構造形成が抑制された。
・適切な発生の順番
ヒトBlastcyst発生では、まずTE cellsとEPI cellsが現れ(5-6 d.p.f.; GATA2+/DAB2+; KLF17+/NANOG+)、次に、PrE cellsと polar TE cells (pTE)が現れるが、この順番は、Blastcyst様構造でも同様に見られた。
初期のTE様細胞は、YAP1が核に局在し、GATA2陽性になる(24 hours)。次に、CDX2+/GATA3+を発現、KLF17/OCT4を維持しながら、NANOGは低下(60 hours)。さらに、OCT4も発現低下した後に、pTE analogs マーカー(OVOL1, GREM2, CCR7, SP6, and NR2F2)を発現する。
EPI analogsは、blastocystマーカー(POU5F1, NANOG, KLF17, SUSD2,
KLF4, ARGFX, GDF3)を安定して発現していた。
PrE analogsは、60 hours以内に出現し、72 hours以内に、GATA4, OTX2, and SOX17を発現した。その後、96 hoursまでに、SMAD (NODAL, BMP2/6, GDF3, ID1/2) and Wnt signaling-related transcripts (WNT3, RSPO3, LBH), extracellular matrix organization関連遺伝子(LAMA1, LAMB1, LAMC1, COL4A1/2)、内胚葉、上皮分化マーカーを発現した。
・子宮内膜細胞(endometrial cells)への接着
受精後7日で、ヒトBlastcystは着床を開始する。この時、TEは、子宮内膜(endometrium)に付着する。そこで、子宮内膜のオルガノイドをから、open-faced endometrial layer (OFEL)を作製し、blastoidを移動させた。
着床の期間は、estrogen (E2) and progesterone (P4)の暴露により、子宮が受容できる期間に限られる。活性化していないOFELでは、Blastoidは付着しないが、活性化したOFELには付着した。この時、Levonorgestrelを添加すると、OFELへの付着は阻害された。Levonorgestrelはホルモン製剤の一つであり、様々な避妊手段に用いられる。
・Epiblast signals が trophectoderm接着を決定している
次にpTE/EPI interfaceの重要性を調べるために、EPIを取り除いた。
LIF濃度を上げると、Blastoid形成が促進したが、GP130 inhibitor (SC144) を添加すると、trophospheres(EPIなし)が形成された。また、Hippo kinases MST1/2 (XMU-MP-1)もtrophospheresを形成した。これらの、trophospheresは、OFELへの付着ができなかった。すなわち、pTEの成熟と着床にはEPIが必要だと分かった。
・ヒト受精卵発生のモデル (day 13まで)
妊娠の診断には、Chorionic Gonadotropin β (CGβ)ホルモンの検出が用いられる。BlastoidからCGβの発現が、ELISAと診断キットで検出された。EPI analogsは、OCT4, SOX2発現を維持する一方、primed pluripotency marker CD24発現も上昇した。ただし、Blastcystと同様に、Day 13以降については、発生ステージは進まなかった。
・今回の肝は、効率よく3細胞系譜を作り出したこと
>これまでは、trophospheresは作れていたが、EPIは作れていなかった。このために、OFELを用いた着床モデルを作ることができた。不妊治療研究に役立ちそう。
・EPIがpTEの成熟に寄与するシグナルは?
>IL6シグナルが効いている?という本文では主張をしているが、まだ詰められていないかな。今後明らかになるのでしょう。
・ヒトとマウスの違い
>pTEの極性のでき方が違うという話を学会で聞いたが、どのように決まるのか、など、マウスで分かることとの違いが、このモデルで確かめられそう。
受精から1週間後、ヒトの胚は子宮に着床する。このとき、胚は、胚を格納する空洞を取り囲む球体からなる胚盤胞を形成する必要がある。幹細胞は胚盤胞モデルを形成することができ、我々はこれを「blastoid」と名付けた。本研究では、Hippo経路、TGF-β経路、ERK経路の3つの経路を阻害したナイーブなヒト多能性幹細胞(PXGL hPSC)が、胚盤胞発生の順序と時期に応じて、3つの創始系譜(97%以上が栄養外胚葉、エピブラスト、原始内胚葉)の胚盤胞段階のアナログを生成するblastoidを効率的(70%以上)に形成することを示した。胚盤胞は自然に第1軸を形成し、上胚葉が極性栄養外胚葉の成熟を誘導し、その結果、着床時のようにホルモン刺激を受けた子宮内膜細胞に付着する特異的な能力を獲得することが観察された。このようなヒトblastoidは、ヒトの着床と発生を研究するための、忠実で拡張可能な倫理的モデルと考えられる。
Harunobu Kagawa et al., Nature. 2021