食べる量をコントロールすることは健康にとても大事ですね。今回の論文では、小脳の深部にあるDCNという神経核が摂食によって活性化される新しい回路を見つけたという論文です。これまでの回路よりも食事量を減らす効果が大きそうです。
“Reverse-translational identification of a cerebellar satiation network”
Aloysius Y T Low et al., Nature. 2021 Nov 17. doi: 10.1038/s41586-021-04143-5. Online ahead of print.
https://www.nature.com/articles/s41586-021-04143-5
・過食を特徴とするPrader Willi syndrome (PWS)の患者では、食べ物に対する小脳の反応に顕著な違いがあることが機能的磁気共鳴画像によって明らかになった。
・マウスのトランスクリプトーム解析により、前部深部小脳核(aDCN)には、摂食や栄養補給によって活性化されるニューロンが存在することが明らかになった。
・aDCNニューロンを選択的に活性化すると、代謝量の変化を伴わずに食事量を減らすことができ、摂食量を大幅に減少させることができた。
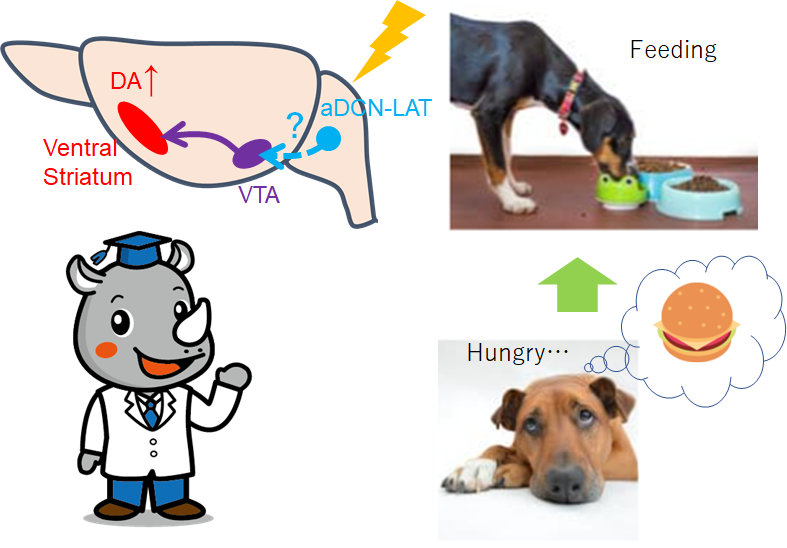
・aDCNニューロンの活性化は、線条体のドーパミンレベルを上昇させ、その後の摂食に対するドーパミン反応を抑制することで、摂食を終了させることを明らかにした。
<技術解説>
・機能的磁気共鳴画像(functional magnetic resonance imaging, fMRI)
非侵襲的に脳機能を計測するのにヒトで良く使われます。これで見るのは血中の酸素飽和度で、神経活動があると酸素が使われることで神経活動を推定します。血中内の赤血球ヘモグロビンが還元型だと常磁性があることを利用して、blood oxygen level dependent (BOLD) signal として測定することができます。参考サイト:脳科学辞典
・DREADD(Designer Receptor Exclusively Activated by Designer Drugs)
前にもでてきた。体内には存在しない合成のリガンドによってのみ活性化されるGPCR受容体を遺伝子工学技術で、特定の細胞に発現させることで、動物に投与してその細胞を活性化(hM3D(Gq) )、または不活性化(hM4D(Gi))することができる。
・fluorescent DA sensor (GPCR-activation-based-DA, GRAB-DA)
Fangmiao Sun et al., Cell. 2018 で開発された蛍光タンパク質のセンサー。特定の細胞に発現させてドーパミンのシグナルを蛍光で測定することができる。
<論文の流れ>
・食物の提示で小脳深部が活性化する
過食を特徴とするPWS患者の神経活動をfMRIでBOLDシグナルを計測することで調べたところ、健常人では、断食時に食物の提示で小脳の深部が活性化されるのに対し、PWS患者では活性化されず、食事後の食物の提示では、健常人でこの部位の活動が低下しているのに対し、PWS患者では低下していなかった。
次にマウスの脳で該当する小脳深部を調べたところ、摂食時にlateral nucleus (LAT) の、deep cerebellar nuclei (DCN) ニューロンが活性化していることを、Homer1aのRNAの発現(RNA in situ hybridization)で調べた。
・aDCNニューロンの活性化は摂食量を低下させる
興奮性DREADDのhM3D(Gq) をanterior(前側) DCN (aDCN) or the posterior(後側)DCN (pDCN)、 Lateral(外側核、LAT)、Interposed(挿入核、INT)で発現させ調べたところ、aDCN-LATニューロンの活性化でのみ、摂食量が抑えられた。このとき、摂食頻度については影響を受けなかった。(ちなみにリバウンド無し)
逆に、抑制性DREADDのhM4D(Gi)をaDCN-LATニューロンを発現させると、摂食量が増加した。
・摂食はDCNニューロンを活性化する
さらに詳細にDCNニューロンを調べたところ、Spp1, Miat and Crhr1陽性の (class
I) と Celf4, Dpp10 and Unc5d陽性の(class II)に分けられ、摂食に対してclass I DCNニューロンが活性化する(Homer1a発現)ことが分かった。また、GCaMP6sのカルシウムイメージングで、グルタミン酸トランスポーター(vGluT2)発現の神経細胞を活動を調べると、絶食時の摂食で、DCNの活動が上がることが分かった。(飽食状態では摂食しても上がらなかった)。
・DCNニューロンは、食餌に対するドーパミン(DA)応答を修飾する
次にDCNニューロンが先行研究で言われている神経回路とどのようになるかを調べた。
まず、空腹に感受性のある、視床下部arcuate nucleus(弓状核)のagouti-related protein (AgRP)陽性の神経細胞は、摂食行動を惹起するが、aDCNとAgRPを同時に活性化したところ、摂食行動は抑制された。(aDCNが優先された)
また、報酬系に関連がある、ventral tegmental area (VTA) のdopamine (DA) ニューロンは、摂食でventral striatumのDA放出を引き起こすことが知られており、このDA放出をGRAB-DAで測定すると、aDCN-LATの活性化により、DAが継続的に放出されることが分かった。(aDCN-INTでは見られない)このDA放出と、摂食量には相関があった。
VTA-DA neuronをhM3D(Gq)で活性化すると、摂食行動が抑えられ、aDCN-LATをhM3D(Gq)で活性化、VTA-DAをhM4D(Gi)で不活性化、を同時に行うと、DA放出は抑えられ、摂食は回復した。
・PWSでは、なぜaDCN-LAT活動が抑制されるのか?
>食べ物のイメージを見るとDCNのBOLDシグナルを上げる仕組み(視覚情報処理、感情との相互作用?)が興味深い。迷走神経も関連しているらしい。
・小脳の行動修正機能として
>小脳はこれまで、運動の制御などの役割がよく調べられています。今回の仕事を見ると、摂食行動を運動と捉えてこれを修飾する機能とも考えられます。そうすると、我々が「意思」と考えているものも、運動の修飾に過ぎないのかもという気がしてきます。
・aDCN-LAT活動によるドーパミン制御について
>ここでは、DCNがVTA-DAに行く経路について細かくは見られていません。また、ventral striatumがDA放出で、ひたひたになると、なぜ新しいDA放出が抑えられるかという仕組みは良く分からないですね。以前紹介した仕事の、エンケファリンとの関係も気になります。https://ceitaro.com/hungry-enkephalin/
脳は体重のホメオスタシスを司る場所である。しかし、増加する肥満を抑制することができないことから、体重制御に関する理解を深めるためには、標準的な摂食経路以外にも目を向ける必要があることが明らかになった。我々は、逆翻訳法を用いて、飽食を促進する神経アンサンブルを同定し、解剖学的、分子的、機能的に特徴づけることに成功した。飽食を特徴とする遺伝子疾患の患者では、食べ物に対する小脳の反応に顕著な違いがあることが、偏りのないタスクベースの機能的磁気共鳴画像によって明らかになった。また、マウスのトランスクリプトーム解析により、前部深部小脳核(aDCN)には、摂食や栄養補給によって活性化されるニューロンが分子的にも地形的にも存在することが明らかになった。aDCNニューロンを選択的に活性化すると、代謝量の変化を伴わずに食事量を減らすことができ、摂食量を大幅に減少させることができた。さらに、線条体のドーパミンレベルを上昇させ、その後の摂食に対するドーパミン反応を抑制することで、aDCNの活性化が摂食を終了させることを明らかにした。本研究は、保存された飽食中枢を定義したものであり、過食を管理するための新たな治療標的となる可能性がある。また、行動に影響を与える神経回路を特定するための「ベッドサイド・トゥー・ベンチ」アプローチの有用性を強調するものである。
Aloysius Y T Low et al., Nature. 2021